В целом о вакууме и вакуумных системах
| Свойства вакуума |
| Особенности вакуумных систем |
Измерение вакуума
| контрольно-измерительная аппаратура |
| Течеискатели |
Вакуумные материалы и уплотнители
| Вакуумные материалы |
| Уплотнители и и смазки |
Элементы вакуумных конструкций
| Вакуумные вентили и переходники |
| Запорные устройства |
| Способы соединения вакуумных систем |
О выборе оборудования
| Общие принципы |
| Подбор вакуумных насосов |
Вакуумные установки
Практические и лабораторные работы
| Масляные средства откачки |
| Вакуумометрические приборы |
| Вакуумные установки |
| Сорбционные средства откачки |
| Физические явления в вакууме |
На заметку
| Источники газа в вакуумной системе |
| В целом о вакууме и вакуумных системах - Особенности вакуумных систем | ||||||||
Течи в вакуумной камере. Если в вакуумной камере имеются какие-либо негерметичности, то атмосферный воздух будет поступать извне в камеру. Поэтому необходимо стремиться к уменьшению числа и размеров течей с тем, чтобы общая скорость натекания газа, по крайней мере, не превышала произведения эффективной быстроты откачки на давление. Допустимые значения QBX для рассмотренного в разд. 3 примера приведены в табл. Большинство твердых материалов, в которых отсутствуют какие-либо дефекты, в достаточной степени газонепроницаемо. Течи возникают, как правило, в местах соединения различных частей вакуумной системы, которые могут быть изготовлены как из одинаковых, так и из разных материалов. Для соединения металлов обычно используют сварку либо пайку твердыми или мягкими припоями. Эти методы позволяют получать высококачественные вакуумные соединения.

Соединения типа стекло — стекло или стекло — металл осуществляются методом сварки. Для материалов, которые невозможно соединить указанными методами, обычно применяют разъемные соединения с уплотнениями в виде прокладок, изготовленных из эластомер-ных материалов, мягких металлов или даже с помощью различных клеев, обладающих достаточно низким давлением паров. Для контроля вакуумных систем широко используются гелиевые течеискатели, которые обладают очень высокой чувствительностью. Гелиевый течеискатель обладает чувствительностью' порядка 1O-12 Па •м3*c-1; это позволяет эффективно контролировать сверхвысокий вакуум (~10-9 Па). Однако следует учитывать, что перепады давления, температуры и механические колебания системы могут привести к возникновению в соединениях деформаций и напряжений, которые в свою очередь могут нарушить герметичность системы. Поэтому весьма важно использовать такие способы изготовления вакуумных соединений, которые обеспечивали бы их вакуумную плотность в условиях эксплуатации. Природу мнимой течи легко понять на конкретном примере. Рассмотрим вакуумную установку, в глухом внутреннем отверстии которой перед сборкой системы установлен винт. В этом отверстии, как в ловушке, оказывается запертым небольшой объем воздуха под атмосферным давлением. При откачке установки воздух из этого объема может проникать в вакуумную систему по резьбе. Соответствующий поток газа определяется проводимостью зазора резьбового соединения и перепадом давления. В конечном счете весь газ из полости будет откачан, и натекание из нее полностью прекратится. Пусть объем газа, находящегося под винтом, составляет 10-6 м3, а проводимость зазора 10-12 м3*с-1 Тогда время, необходимое для полного удаления газа из полости, составит
Поэтому проблема мнимой течи состоит вовсе не в том, что невозможно создать в системе предельный вакуум, а в том, что время, необходимое для этого, может оказаться слишком большим. Фактическое время достижения предельного вакуума зависит от эффективных величин V и С. Мнимые течи могут быть легко устранены путем тщательного конструирования элементов вакуумной системы. Если молекула жидкости или твердого тела обладает достаточной кинетической энергией для преодоления сил сцепления с другими молекулами, то она может перейти в газовую фазу. Этот процесс, называемый испарением1), осуществляется непрерывно, поскольку вследствие случайного распределения скоростей молекул всегда существуют частицы с энергией, достаточной для перехода в газовую фазу. Если значительную часть объема сосуда, содержащего газ, занимает жидкость (или твердое тело), то все испарившиеся молекулы будут оставаться в замкнутом объеме сосуда и, следовательно, как плотность, так и давление пара будут непрерывно возрастать. Если молекулы газа ударяются о поверхность единичной площади с частотой v. Очевидно, что в рассматриваемом случае давление газа в сосуде будет возрастать до некоторого равновесного значения р при котором скорость испарения W с единичной площади равна скорости обратного процесса (конденсации). Если все молекулы, ударяющиеся о поверхность жидкости (твердого тела), поглощаются, для условий равновесия имеем
Предположение о том, что вероятность прилипания равна единице, было изучено Лэнгмюром, а также Верхойком и Маршаллом. На основе имеющихся экспериментальных данных авторы пришли к выводу о справедливости этого предположения, когда газ и жидкость представляют одно и то же соединение. Равновесное давление паров pv может быть определено из термодинамического уравнения Клапейрона — Клаузиуса:
где Vt и Vk — мольные объемы газовой и конденсированной фазы соответственно, LK — теплота испарения. В условиях вакуума получим
где Na — число Авогадро, т. е. число молекул в одном моле газа. Предполагая, что теплота испарения не зависит от давления паров, и интегрируя уравнение (1.40), можно получить
где а и b — константы. Этому закону в условиях сверхвысокого вакуума удовлетворяет равновесное давление паров большинства веществ. Поскольку скорость испарения W зависит только от числа частиц, обладающих достаточной для выхода энергией, давление над поверхностью жидкости не влияет на величину W. Таким образом, скорость испарения в вакуум любой степени зависит только от температуры и природы вещества:
Поток с единицы поверхности испаряющегося вещества равен где р'— давление паров над поверхностью жидкости. Если величина произведения этого удельного потока на площадь поверхности испаряющегося вещества сравнима со скоростью откачки, то в этом случае процесс испарения будет определяющим. Причину газовыделения с поверхности можно понять из рассмотрения взаимодействия газов с твердыми телами. При столкновении молекулы с поверхностью твердого тела она либо мгновенно отражается, либо в течение некоторого времени удерживается поверхностью и только после этого отрывается и движется в произвольном направлении относительно направления удара. Силы, которые вызывают прилипание молекулы к стенке, имеют различную природу. Молекула может удерживаться стенкой за счет сил межмолекулярного притяжения, которые аналогичны силам, вызывающим отклонение поведения газов от идеального, что учитывается соответствующими поправочными коэффициентами в уравнении состояния идеального газа, введенными Ван-дер-Ваальсом. Молекулы при ударе о поверхность могут диссоциировать на атомы, которые взаимодействуют с молекулами поверхности, образуя химические связи. Проникновение молекул или атомов внутрь стенки облегчает процесс захвата частиц газа поверхностью. Можно считать, что система газ — поверхность обладает некоторой энергией связи Е, которая определяется как энергия, освобождаемая при переходе одного моля газа из газовой фазы в связанное состояние. Эту энергию часто называют энергией активации десорбции. При наличии только ван-дер-ваальсовских сил величина E всегда положительна. Для того чтобы удалить газ с поверхности, необходимо затратить энергию, превышающую Е. Вследствие теплового движения частиц поверхности всегда существует вероятность передачи этими частицами своей энергии связанным молекулам при столкновении. Как известно из статистической физики, вероятность того, что связанная молекула в какой-то момент времени обладает энергией Е, пропорциональна ехр[—(E/RT)], где R = — газовая постоянная. Таким образом, если поверхностью адсорбировано Na молекул, то скорость десорбции определяется выражением
где В — константа. Если предположить, что из всех молекул, ударяющихся о поверхность, будет адсорбироваться только некоторая часть, то в этом случае скорость адсорбции с учетом выражения (1.9) описывается выражением
Величину f часто называют коэффициентом прилипания. В условиях равновесия скорости адсорбции и десорбции равны. Тогда из уравнений (1.44) и (1.45) получим
Из этого выражения видно, что число молекул газа, адсорбированных поверхностью единичной площади, увеличивается с повышением давления газа и уменьшается с ростом температуры (при Е>0). Зависимость NA от р при постоянной температуре называется изотермой адсорбции. Предположения, лежащие в основе вывода выражения (1.46), не вполне корректны. Например, если адсорбция молекул газа осуществляется на некоторых «активных» участках поверхности, то число этих участков уменьшается по мере увеличения количества адсорбированного газа. Кроме того, наблюдается так называемый эффект экранирования, заключающийся в том, что адсорбированные поверхностью молекулы закрывают доступ к поверхности новым молекулам. Последние взаимодействуют уже не с самой поверхностью, а с мономолекулярным слоем адсорбированных молекул; энергия этой связи значительно меньше. С учетом указанных эффектов были получены уточненные выражения для изотерм адсорбции. Однако, вне зависимости от вида изотермы, в равновесных условиях всегда некоторая часть газа адсорбирована поверхностью. При нарушении равновесия, например при уменьшении давления газа, некоторая часть адсорбированных молекул должна перейти в газовую фазу для достижения равновесия в новых условиях. Поскольку скорость поступления молекул в газовую фазу определяет поток газа, который должен быть откачан из системы, весьма важно рассмотреть скорость десорбции адсорбированных молекул и время, необходимое для достижения равновесия. В условиях равновесия число молекул, адсорбированных на поверхности единичной площади, определяется выражением
где т — среднее время пребывания молекулы на поверхности. С учетом выражения для Va (1-45) имеем
Далее из уравнений (1.48) и (1.46) находим
Согласно Френкелю, это выражение можно записать в виде
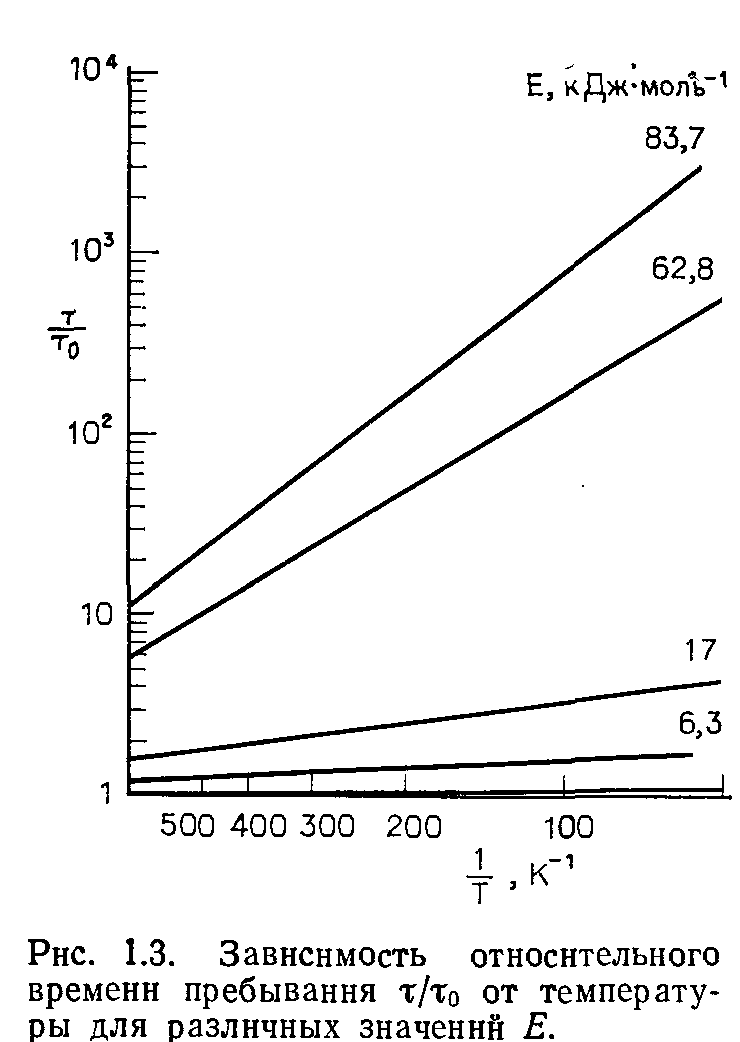
Поскольку за время т в среднем все адсорбированные молекулы заменяются новыми молекулами, очевидно, что т и есть время достижения условия равновесия при условии, что быстрота откачки системы не является лимитирующим фактором. Таким образом, выражение для времени пребывания т можно использовать для нахождения приближенного значения времени достижения равновесия. Энергия связи E (адсорбции) зависит от типа связи молекул с поверхностью и может быть определена экспериментально посредством прямых калориметрических измерений. Энергия связи E (в случае физической адсорбции соответствующая теплоте адсорбции) увеличивается с повышением температуры кипения Ттв. Так, для гелия теплота адсорбции приблизительно равна 590 Дж*моль-1; для водорода теплота адсорбции составляет около 6,3 кДж*моль-1; для аргона, азота, кислорода и окиси углерода температуры кипения находятся в диапазоне 77,3-90,1 К, а интервал значений соответствующих теплот адсорбции 12-17 кДж*моль-1. В случае химической адсорбции величины энергий связи значительно возрастают. Например, энергия связи кислорода с поверхностью титана равна 103 кДж*моль-1. Определение величины то является более трудной задачей. Френкель предположил, что время пребывания непосредственно связано с периодом колебаний адсорбированных атомов в направлении, перпендикулярном поверхности. При этом значения то находятся в пределах 10-12—10-14 с. Для физической адсорбции рассмотренных газов при комнатной температуре вычисленное значение т меньше 10-10 с, из чего можно заключить, что процессы адсорбции и десорбции на поверхности протекают практически мгновенно. Это подтверждается многочисленными примерами адсорбции различных газов. В связи с этим использование в качестве наиболее вероятного значения To=IO-13 с представляется сомнительным. Сообщалось о таких больших значениях то, как 1 с. Таким образом, очевидно, что существующее представление о механизме процессов, влияющих на скорость достижения равновесия между газовой фазой и адсорбированными молекулами, далеко не полное, что требует дальнейших исследований в этом направлении. Несмотря на сложность определения величины то, можно предположить, что повышение температуры поверхности должно приводить к уменьшению времени достижения равновесия. На рис. 1.3 представлена зависимость величины отношения т/то от температуры для различных значений энергии адсорбции E в логарифмических координатах.  Согласно уравнению (1.50), графики этой зависимости представляют собой прямые линии.
Уменьшение величины т/то и, следовательно, т при повышении температуры поверхности от комнатной до 500 К становится значительным для случаев, когда энергия адсорбции превышает 20 кДж-моль-1. Однако для вакуумных систем более значимым является время откачки до равновесного давления, а не т, а в случае химической адсорбции даже при больших т скорость десорбции может быть настолько медленной,что десорбция не будет влиять ни на время откачки, ни на предельно достижимое давление (см. табл. 1.1). Этот эффект продемонстрирован в ряде работ, где получены зависимости времени, необходимого для достижения заданного давления в системе (в которой приток газа происходит за счет десорбции монослоя адсорбированных молекул с поверхности площадью 10-2 м2), при скорости откачки 10-3 м3*с-1 (рис. 1.4). Из рисунка видно, что временные характеристики имеют максимум при 100<?< 180 кДж-моль-1 в зависимости от требуемого предельного давления. Таким образом, газовыделение с поверхности происходит тогда, когда равновесие между слоем адсорбированных на поверхности молекул газа и молекул в газовой фазе нарушено. Этот процесс протекает быстро и при достижении равновесия прекращается. В большинстве случаев время достижения равновесия очень мало, но при некоторых обстоятельствах оно становится значительным. В этих случаях повышение температуры поверхности способствует сокращению времени, необходимого для установления равновесия.
 Предположим, что в материале стенки камеры равномерно растворен газ с концентрацией с. Если в каком-либо элементе объема происходит изменение концентрации газа, то возникает ее градиент. Тогда, согласно первому закону Фика, диффузионный поток газа Q через поверхность единичной площади в направлении, противоположном градиенту концентрации, определяется выражением Q = —D{dc/dx), (1.51) Из условия сохранения массы газа для бесконечно малого объема с учетом выражения (1.51) можно получить уравнение для скорости изменения концентрации газа в любой точке среды — второй закон Фика:
В качестве примера использования этого закона для случая объемного обезгаживания рассмотрим стенку, одна из поверхностей которой граничит с вакуумом. Для упрощения предположим, что стенка полубесконечна, а начальная концентрация; растворенного газа равна с<>. После того, как стенка помещена в вакуум (?=0), концентрация газа на границе раздела (х=0) становится равной концентрации газа в вакууме. Для простоты будем считать, что вакуум абсолютный, т. е. с = 0 при х = 0. Используя эти граничные условия, получим следующее решение уравнения (1.53):
С учетом первого закона Фика получим удельную скорость газовыделения в произвольный момент времени: (1.55) Таким образом, скорость газовыделения зависит от времени по закону t~l/z, а влияние температуры определяется параметром jD1/2, который имеет вид
С повышением температуры скорость газовыделения возрастает, а время достижения состояния равновесия уменьшается. Как и в случае поверхностного обезгаживания, при объемном газовыделении влияние температуры на скорость достижения равновесия определяется энергией активации Ед. Причиной диффузии газа в материале стенки становится наличие градиента концентрации растворенного в стенке газа. Однако градиент концентрации газа может быть вызван и разностью давлений на стенках вакуумного сосуда. Количество газа, растворенного в твердом теле, находящемся в газовой среде при давлении р, обычно подчиняется закону Генри для малых концентраций:
где S — коэффициент растворимости. Для большинства газов я=1; однако для двухатомных газов, которые при растворении в металлах диссоциируют, п= 1/2. Установившийся поток газа сквозь, стенку камеры при наличии перепада давления, согласно первому закону Фика, определяется соотношением
Интегрируя это выражение методом разделения переменных, получим
где d — толщина стенки камеры, a с1 и с2 — концентрации газа на поверхностях, граничащих с вакуумом и атмосферой соответственно. Выражая концентрации с помощью закона Генри (1.58), определим Q:
где DS — так называемый коэффициент проникания. Поскольку и D, и S экспоненциально зависят от температуры, коэффициент проникания очень быстро возрастает с повышением температуры. Вообще говоря, для большинства сочетаний газ — стенка при комнатной температуре этот эффект незначителен, за исключением случая проникания, гелия сквозь различные стекла. Тем не менее следует учитывать, что нагрев вакуумной камеры, используемый для поверхностного и объемного обезгаживания стенок, может приводить к натеканию газа в вакуумную систему вследствие его проникновения сквозь стенки.
|
Сейчас на сайте
Сейчас на сайте находятся:84 гостей на сайте
Нов боков адс адаптивный
| = | |
 Ч.54)
Ч.54) (1.56.)
(1.56.)